Soluția Conceptul
Soluția se numește sistem omogen de compoziție variabilă. Compoziția chimică și proprietățile fizice ale soluției în toate părțile din volumul său sunt aceleași.
Spre deosebire de simpla amestecare a substanțelor prin dizolvarea interacțiunii dintre particule. formând o soluție.
Adesea folosit pentru a defini noțiunea de o soluție omogenă și de sistem.
În acest caz, soluția se numește un sistem omogen. constând din două sau mai multe componente.
sisteme eterogene și omogene
Sistemul Omogen (din όμός grecesc - egal, egal ;. Γένω - urs) - sistem omogen, compoziția chimică și proprietățile fizice ale care toate părțile sunt aceleași sau variază în mod continuu, fără salturi (nici o interfață între părți ale sistemului).
Într-un sistem omogen format din două sau mai multe componente chimice, fiecare componentă este distribuit pe parcursul unui bloc de molecule, atomi, ioni. Componentele unui sistem omogen nu pot fi separate unul de altul mecanic.
Sistemul heterogen (Din έτερος grecesc - diferit;. γένω - urs) - sistem eterogen alcătuit din părți omogene (faze), separate prin interfața.
Soluțiile pot exista în trei stări de agregare - solidă, lichidă și gazoasă (vapori). soluții solide exemplare includ anumite aliaje metalice, cum ar fi de aur și aliaje de cupru, gaz - aer.
Cel mai important tip de soluție - soluții lichide.
Soluțiile sunt esențiale în viața umană. Astfel, procesele de digestie om și animalele sunt asociate cu transferul de nutrienți în soluție. Soluțiile sunt toate fluidele fiziologice importante (sânge, limfă, etc.).
solvenți
Fiecare soluție formată din soluți și solvent, adică, mediul în care aceste substanțe sunt uniform distribuite sub formă de molecule și ioni.
De obicei, solventul este considerată o componentă care există în formă pură, în aceeași stare agregat, iar soluția rezultată. De exemplu, în cazul solventului sare apos este apa.
Dacă ambele componente au fost să se dizolve într-o stare similară de agregare (de exemplu, alcool și apă), apoi solventul este considerat componentele situate în sumă mai mare.
Adevăratele soluții și coloidal
În soluții de substanțe pot fi în diferite grade de finețe (adică fragmentare). Dimensiunea particulelor este o caracteristică importantă care contribuie la multe proprietăți fizice și chimice ale soluțiilor.
soluțiile cele mai mari particule sunt împărțite în:
1. soluții adevărate (dimensiunea particulelor mai mică de 1 micron) și
2. Soluțiile coloidale (o dimensiune a particulei de 1 până la 100 microni).
Amestecurile de particule mai mari de 100 de microni pentru a forma tulbureala: suspensii și emulsii.
soluții adevărate pot fi ionici sau molecular în funcție de substanța dizolvată disociază în ioni sau starea nedisociate rămâne într-o moleculă.
Soluții coloidale foarte diferite în proprietăți de soluții adevărate. Ele sunt eterogene. deoarece acestea au interfața dintre faze - solut (faza dispersată) și (mediu de dispersie) solvent.
Soluții de compuși cu masă moleculară mare: proteine, polizaharide, cauciuc au proprietățile ambelor soluții adevărate și coloidale și evidențiate într-un anumit grup.
Soluții amestec mecanic și compuși chimici
Soluții Uniformitate le face foarte similar cu compușii chimici.
Compusul chimic - o substanță complexă compusă din atomi legați chimic de două sau mai multe elemente.
Soluția nu este un compus chimic singur, și cel puțin două compus amestecat. Spre deosebire de substante de amestec simplu, interacțiunea are loc între particule, formând o soluție prin dizolvarea.
Izolarea termică în timpul dizolvării unor substanțe indică, de asemenea, interacțiunea chimică dintre solvent și solutului.
Spre deosebire de soluțiile de compuși chimici este faptul că compoziția soluției poate varia în limite largi. În plus, proprietățile de soluție pot detecta multe dintre proprietățile componentelor sale individuale, care nu se observă în cazul unui compus chimic.
Inconstanța soluții de compoziție aproximează amestecurile lor mecanice.
amestec mecanic - sistem fizico-chimice, care este format din doi sau mai mulți compuși chimici (componente). Amestecul de materii prime sunt incluse neschimbate. Când amestecul nu se produce, nici o substanță nouă.
Din amestecurile mecanice ale soluțiilor diferă drastic omogenitatea lui. Astfel, soluțiile într-o poziție intermediară între amestecurile mecanice și chimice ale compușilor.
dizolvare
Se dizolvă cristalele în lichidul este după cum urmează.
Când introdus în cristalul lichid, prin care poate fi dizolvat de pe suprafața detașeze molecule individuale. Ultima prin difuzie distribuite uniform în volumul de solvent.
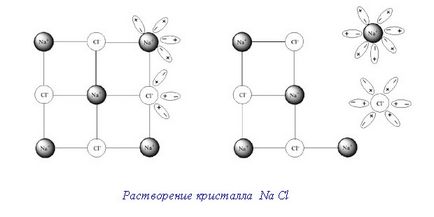
Separarea moleculelor de pe suprafața unui corp solid este numit, pe de o parte, propria lor mișcare de vibrație, dar pe de altă parte - atragerea moleculelor de solvent.
Acest proces ar trebui să continue până la dizolvarea completă a oricărui număr de cristale nu a avut loc dacă procesul invers - cristalizare. A trecut în molecula soluția a atins suprafața substanțelor nedizolvate din nou atras de ea și o parte din cristalele.
Se înțelege că eliberarea de molecule dintr-o soluție va merge mai repede cu atât mai mare concentrația soluției. Și, din moment ce acesta din urmă ca dizolvarea crește fondul, în cele din urmă vine un moment în care rata de dizolvare devine egală cu rata de cristalizare. Apoi, un echilibru dinamic. la care se dizolvă în unitatea de timp și același număr de molecule cristalizează.
Soluția care este în echilibru cu substanța dizolvată este numită o soluție saturată.
concentrarea soluțiilor
Soluție saturată este necesară utilizarea relativ rare. In cele mai multe cazuri, sunt utilizate soluții nesaturate, adică cu o concentrație solutului mai mică decât cea în soluție saturată.
Concentrarea soluției se referă la cantitatea de substanțe dizolvate conținute într-o anumită cantitate de soluție sau solvent.
Soluțiile cu concentrații ridicate de substanțe dizolvate sunt numite concentrate. low - diluat.
Concentrarea soluției poate fi exprimată în diferite moduri:
1. Procentul de solut în raport cu întreaga cantitate de soluție.
2. Numărul de molecule gram de substanță conținută într-un litru de soluție.
3. Numărul de moli de solut conținut în 1000 g de solvent, etc.
solubilitate
Solubilitatea este capacitatea substanței de a se dizolva într-un solvent dat.
O măsură a solubilității substanței în condițiile date este concentrația sa saturată soluție.
Solubilitatea substanțelor diferite variază în limite largi.
- Dacă 100 de grame de apă se dizolvă 10 g dintr-o substanță, substanța se numește bine solubilă.
- Dacă mai puțin de 1 g de substanțe solubile - puțin solubilă.
- În cazul în care soluția devine mai mică de 0,01 g de substanță, atunci substanța este numită practic insolubilă.
Principii pentru a prezice solubilitatea unei substanțe care nu este încă cunoscută. Cu toate acestea, de obicei, o substanță constituită din molecule polare, și substanțe cu un tip de conexiune ionice sunt mai solubili în solvenți polari (apă, Spiro, amoniac lichid) și substanțele nepolare - în solvenți nepolari (benzen, bisulfura de carbon).
Dizolvarea majorității solidelor este însoțită de absorbția căldurii. Acest lucru se explică prin cheltuielile unei cantități importante de energie la distrugerea rețelei cristaline a unui corp solid, care este, de obicei, nu sunt pe deplin compensată de energia eliberată în formarea hidraților (solvați).
De obicei, creșterea temperaturii ar trebui să crească solubilitatea solidelor.