Oxigenul reactioneaza cu ceea ce
23. Oxigenul și proprietățile sale
Oxigen (O) este în perioada 1, VI al grupului în principalele subgrupe. p element. 1s22s22p4 electronic de configurare. Numărul de electroni în nivelul exterior - 6. Oxigenul poate lua 2 electroni și dând în cazuri rare. oxigen valența 2, starea de oxidare -2.
Proprietăți fizice: oxigen (O2) - gaz incolor, inodor și fără gust; ușor solubil în apă, puțin mai greu decât aerul. La -183 ° C și 101325 Pa oxigen este lichefiat, dobândind o culoare albăstruie. Structura moleculară: molecula de oxigen diatomice, în condiții normale de durabile, are proprietăți magnetice. Bond în covalentă nepolară moleculă. Oxigenul are modificarea alotropic - ozon (O3) - oxidant mai puternic decât oxigenul.
Proprietăți chimice: înainte de finalizarea nivelului de energie au nevoie de 2 electroni oxigen primește -2 arată gradul de oxidare, dar în combinație cu fluor-oxigen OF2 O2F2 -2 și -1. Datorită activității chimice a oxigenului reacționează cu aproape toate substanțele simple. Cu oxizi formă metale și peroxizi:
Oxigenul nu este reacționează numai cu platină. La temperaturi ridicate și ridicate vor reacționa cu multe nemetale:
Oxigenul nu este reacționat direct cu halogeni. Oxigen reacționează cu multe substanțe complexe:
reacția de ardere cu oxigen caracterizat prin:
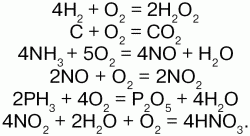
Oxigenul arde multe substanțe organice:
In oxidarea cu oxigen acetaldehidei, se obține acid acetic:
Mod de preparare: într-un laborator: 1) prin electroliza unei soluții alcaline apoase: în care hidrogenul este eliberat la catod și la anod - oxigen; 2) descompunerea clorat de potasiu, atunci când este încălzit: 2KSlO3 2KSl + 3O2;? 3) oxigen foarte pură sunt: 2KMnO4 K2MnO4 + MnO2 + O2?.
Fiind în natură: oxigenul este 47,2% din masa crustei. În starea liber conținut în aer - 21%. Face parte din mai multe minerale naturale, numărul mare de organisme găsite în plante și animale. Oxigenul naturală este format din trei izotopi: O (16) O (17) O (18).
Aplicație: utilizate în industria chimică, metalurgică, în medicină.