Ce este dizolvarea în himii_4
Determinarea solubilității substanțelor
Soluția se numește un sistem de compoziție variabilă cu o singură fază care conține două sau mai multe componente. Substanța este prezentă în soluție în cantități mari, în general, denumite substanțele solvent și alți - soluți. Dacă una dintre substanțele este o soluție lichidă, și alte-solid sau gazos, apoi solventul este numit de obicei o fază lichidă chiar și atunci când alte substanțe sunt prezente în soluție în cantități mari.
Solventul este, de asemenea, considerată starea fizică substanță care nu se schimbă în timpul formării soluției.
Soluție de stat este determinată de trei parametri: temperatură, presiune și concentrație soluților.
După dizolvarea solidă, lichidă sau gazoasă substanță în solventul ales la p. T = concentrația soluție const nu cresc la infinit. Mai devreme sau mai târziu, substanța în cazul în care acesta nu are nici o solubilitate nelimitată încetează să se dizolve, se realizează o anumită concentrație, care chiar și cu contactul prelungit al solut și solvent în condiții de amestecare intensivă nu se mai schimbă, rămâne constantă. Acesta este un semn de la debutul echilibru fază:
unde Bk - substanța cristalină dizolvată; Bp - soluție.
Concentrația maximă posibilă a solutului echilibrului fazei corespunzătoare se numește solubilitatea substanței în solvent la o anumită temperatură și presiune. Solutia fiind echilibrul de fază cu substanța dizolvată este numită saturată.
O soluție saturată poate exista numai în contact (prin interfața) cu solutului. soluții saturate poate fi concentrat sau diluat pentru în funcție de solubilitatea substanțelor. De exemplu, soluția saturată conține AgNO3 la 20 ° C, 216 g sare în 100 g de apă, și o soluție saturată de AgBr la aceeași temperatură în toate 1,2 • 10 -5 g în aceeași cantitate de apă.
În final, există soluții nesaturate - soluții în care, sub temperatura dată și presiune poate avea dizolvarea ulterioară a substanței conținute. Astfel de soluții reprezintă întotdeauna sistem monofazic.
Tehnica de dizolvare a substanțelor cristaline în fluide, în majoritatea cazurilor, nu este complicat. Dizolvarea este efectuată după ce materialul de măcinare. deoarece viteza de dizolvare a cristalelor depinde de mărimea lor. Cu cât cristalele, mai lent dizolvarea ei la o temperatură dată.
Din cauza compresibilității scăzute a lichidelor solubilitatea substanțelor este, în esență independentă de presiune. Creșterea temperaturii poate crește pe măsură solubilitatea substanței și reducerea acestuia. Substanțe cunoscute a căror solubilitate este practic independentă de temperatură. Dizolvare majoritatea sărurilor și nonelectrolytes - endotermic, însoțită de răcirea soluției formate. Prin urmare, în conformitate cu principiul creșterii temperaturii Le Chatelier crește solubilitatea acestor substanțe.
Substanțe de dizolvare este realizată în general cu agitare mensure amestec de faze lichide și solide cu o baghetă de sticlă în timp ce poartă pe piesa de capăt din cauciuc sau plastic pentru furtun. Acest proces este mai bine realizate în baloane Erlenmeyer (vezi. Fig. 21), în care amestecarea manuală a fluidului nu va provoca stropirea.
Când solutului este lent, amestecul a fost matur și se aplică agitarea mecanică (Fig. 178 a, b).
În cazul în care dizolvarea se efectuează la încălzire, substanța de pulbere, 83 se introduce în porțiunile de lichid. Aspectul navei la fundul stratului încălzit de substanțe insolubile poate cauza supraîncălzirea locală a vasului și distrugerea acestuia.
Solut la fierbere, solvent organic se realizează într-un balon cu trei gâturi 4 (fig. 178 b), echipat cu un agitator cu palete mai bun rabatabile (vezi. Fig. 184, de asemenea).
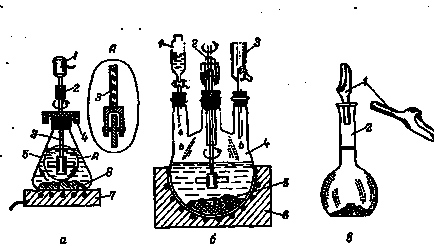
Fig. 178. Receptacles pentru dizolvarea solidelor cu un agitator (a) și solvent organic ebulat (b) .1 volumetric pâlnie balon găleată (a): 1 - un motor; 2 - tub de cauciuc; 3 - agitator de sticlă; 4 - tub PTFE; 5- bulb; 6- solute; 7- aragaz; b: 1 - pâlnie de separare; 2 - agitator; 3 - frigider; 4 - becul; 5 - solute; 6 manta de încălzire
1 pâlnie de separare se utilizează pentru a adăuga un solvent organic, atunci când este necesar, și condensator de reflux 3 returnează vaporizat solventul înapoi în balon.
soluții de concentrație predeterminate sunt preparate cu baloane aplicate 2 (vezi. fig. 75) în care se introduce o probă de pulbere din solutului prin pâlniile cupă 1 (Fig. 178 in). Folosite în acest scop ochelari de ceas sau hârtie de calc (pergament) nu este recomandată datorită posibilității pierderii unei părți a particulelor. O porție cântărită din substanța se poate turna din flaconul de cântărire (vezi. Fig. 57), în porțiuni mici, printr-o pâlnie curat și uscat cu o țeavă scurtă și lată (cu fig. 197, b) ușor atingând cu un deget pe pâlnie, tubul nu este înfundat substanță. Apoi, folosind șaiba (vezi. Fig. 31), se spală cu solvent resturile de materie solide pure din flaconul de cântărire deasupra pâlniei și apoi se spală de mai multe ori pâlnie. operațiuni similare sunt efectuate cu găleata și o pâlnie, în care solutul este cântărit direct.
Dacă există temerea că solventul va reacționa cu sticla. se recomandă să se utilizeze un vas de măsurare realizat din polipropilenă transparentă sau alte materiale polimerice transparente.
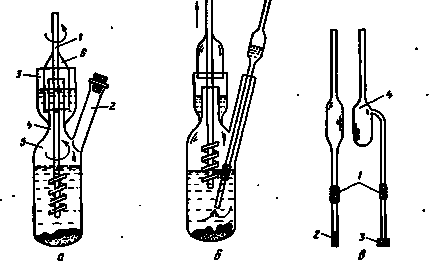
Fig. 179. receptacul pentru determinarea solubilității solidelor (a). Eșantionarea (b). Pipete pentru prelevarea de probe (în)
Determinarea solubilitatea unui solid se realizează în vase speciale cu agitatoare. Anterior a studiat solid a fost măcinat într-o pulbere fină care este posibil, și transferat într-un recipient de sticlă 5 (Fig. 179, precum și) prin gât 4 prin intermediul unei pâlnii sau prin vasul proces 2. Apoi, solventul a fost turnat în 2/3 volum de inserție mixer / clopot cu 6, este turnat în lichidul de etanșare buzunar 3 nu interacționează cu solventul nu dizolva vaporii, și plasat într-un vas agitat cu termostat necesar fluctuații admisibile de temperatură constantă, care nu depășesc ± 0,05 ° C Se atașează un ax agitator de sticlă, cu un tub de cauciuc pe axa motorului cu o viteză reglabilă. Tubul de cauciuc trebuie să fie suficient de groasă pentru a nu fi răsucite în timpul funcționării agitatorul și axa agitatorului și motorul este mutat foarte aproape. Un termometru de referință în cuptor lângă vasul care este imersată într-un lichid termostatic, astfel încât nivelul lichidului din vasul Naudé sub nivelul lichidului din termostat. După terminarea acestor operații, motorul electric și reglarea vitezei de agitare. Viteza de rotație este fixat astfel încât lichidul nu este pulverizat în vas, o mare parte din faza solidă este în suspensie, iar clopotul 6 în timp ce rotirea agitatorului nu atinge pereții de buzunar 3 și 4 ale gâtului.
Controlul stabilirea echilibrului se realizează selectarea periodic soluția de probă (Fig. 179, b) și determinarea concentrației de solut. Probele au fost luate fie ca volum sau greutate pipete filtru 2 la sfârșitul anului. Filtrul poate fi o placă de sticlă poroasă 3 sudate pe tub, tamponul din fibre polimerice. lână sau hârtie de filtru, rezistent la mediu, lichidul. Capetele pipetele se filtrează detașabil, atașabilă la capătul pipetei cu un tub de cauciuc 1. După îndepărtarea pipeta din capătul containerului cu filtrul este îndepărtat, iar proba de lichid se toarnă într-un flacon de cântărire pentru analiză. Suspensia a fost retrasă de pe vas, fără capătul pipetă detașabil.
Dacă temperatura vasului fiind într-un cuptor, deasupra camerei și solubilitatea substanței scade brusc odată cu scăderea temperaturii, atunci când ia o soluție de probă pipetă este preîncălzit la o temperatură de 10 - 20 de ° C peste temperatura lichidului în termostat. Acest lucru este prevăzut într-o stepa pipete netransformate soluție saturată este încălzită într-un cuptor.
În cazul în care observațiile arată că substanța este ușor solubilă în solventul luate, echilibrul se realizează rapid și în mod liber la numărul de probe prelevate după 2 - 3 ore, nu mai mult de trei sau patru. Faza de echilibru slab substanțe solubile este stabilită în mod semnificativ mai lung în techesh câteva zile, săptămâni sau chiar luni. În acest caz, probele au fost luate la 5 - 10 ore, iar numărul lor în mod semnificativ. Equilibrium se realizează atunci când analiza ultimelor două sau trei eșantioane de aceeași din cadrul erorii experimentale.
Pentru mai multe nave de echilibrare rapidă cu o substanță și un solvent este mai întâi încălzit sub agitare la o temperatură de 15 - 20 de ° C peste temperatura la care programată pentru a determina solubilitatea substanței, iar apoi vasul a fost scufundat într-un termostat reglat la o temperatură studiat echilibru de fază. În această parte soluție din substanța este eliberată pentru a accelera realizarea unui echilibru între faza solidă și soluție. In mod similar, determinarea solubilității este efectuată la alt temperaturax dacă este necesar să se examineze solubilitatea substanțelor într-un interval larg de temperaturi.